Fe – 2 е = Fe2+; Al – 3 е = Al3+.
Образующиеся ионы способны подвергаться гидролизу по схеме:
Fe2+ + H2O = FeOH+ + Н+ , Al3++ H2O = Al OH2++ Н+,
FeOH+ H2O = Fe(OH)2 + Н+ , AlOH2++ H2O = Al(OH)2++ Н+,
Al(OH)2++ H2O = Al(OH)3 + Н+.
Ионы Fe2+, гидроксид железа (II) окисляются растворенным в воде
кислородом:
4Fe2+ + О2 + 2H2O = 4 FeOH2+, 2Fe2+ + 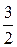 О2 + 3H2O = 2Fe(OH)3 + 3Н+,
О2 + 3H2O = 2Fe(OH)3 + 3Н+,
4Fe(OH)2 + О2 = 4FeOOH + 2H2O.
Образующиеся ионы Fe3+ , FeOH2+ также подвергаются гидролизу:
Fe3+ + H2O = FeOH2+ + Н+ , FeOH2+ H2O = Fe(OH)2+ + Н+,
Fe (OH)2+ H2O = Fe(OH)3 + Н+.
Подобные процессы протекают при анодном растворении металлов под действием тока.
Возможность и полнота протекания этих процессов зависят от рН среды. Гидролиз ионов Fe2+, Fe3+, Al3+ сопровождается понижением величины рН. рН при гидролизе может быть рассчитана по следующей формуле:
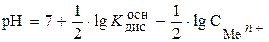 , (3.8)
, (3.8)
где 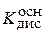 – константа диссоциации гидроксида железа (II), (III) или гидроксида алюминия (III) по соответствующей стадии;
– константа диссоциации гидроксида железа (II), (III) или гидроксида алюминия (III) по соответствующей стадии;
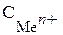 – концентрация иона соответствующего металла в растворе (моль/дм3).
– концентрация иона соответствующего металла в растворе (моль/дм3).
Значения рН при гидролизе в зависимости от концентрации ионов в растворе представлены в табл. 3.2.
Образование гидроксидов металлов Fe(OH)3, Fe(OH)2, Al(OH)3 зависит от величины произведения растворимости (ПР) гидроксидов и концентрации ионов в растворе.
|
|
|
рН, соответствующую началу осаждения гидроксидов, можно определить по следующему уравнению:
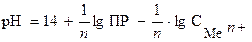 . (3.9)
. (3.9)
Значения величины рН осаждения гидроксидов в зависимости от концентрации ионов в растворе представлены в табл. 3.3.
Таблица 3.3
Определение величины рН при гидролизе ионов металлов и рН начала осаждения гидроксидов
| Процесс | Ионы Fe2+, моль/дм3 | Ионы Fe3+, моль/дм3 | Ионы Al3+, моль/дм3 | |||||||||||||
| 0,1 | 0,01 | 1,0 | 0,1 | 0,01 | 0,1 | 0,01 | ||||||||||
| Стадия гидролиза: | рН при гидролизе | |||||||||||||||
| 5,05 | 5,55 | 6,06 | 1,056 | 1,56 | 2,06 | 4,57 | 5,07 | 5,57 | ||||||||
| – | – | – | 1,628 | ,13 | 2,63 | – | – | – | ||||||||
| Осаждение | рН начала осаждения | |||||||||||||||
| 6,45 | 6,7 | 7,116 | 1,599 | 1,93 | 2,259 | 5,70 | 6,03 | 6,36 | ||||||||
В процессе анодного окисления железа возможно образование целого ряда соединений, гидратированных и комплексных ионов: Fe2+, Fe3+, FeOH+, Fe(OH)2, FeOH2+, Fe(OH)3 , Fe(OH)2+, Fe(OH)4–, термодинамическая устойчивость которых будет также зависеть от рН среды и окислительно-восстановительного потенциала.
Эта зависимость может быть определена по уравнению Нернста. Например, для полуреакции Fe2+ +3H2O + е = Fe(OH)3 + 3Н+ оно примет вид:
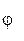 =
= 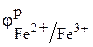 +
+ 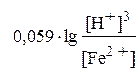
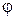
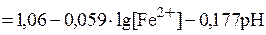 . (3.10)
. (3.10)
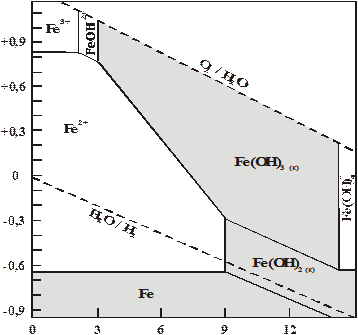
Эти зависимости обычно представляют в виде диаграммы Пурбе – зависимости электродного потенциала различных ионных форм металла от рН среды, которая для системы Fe–H2O в упрощенном виде представлена на рис. 3.6.
На диаграмме показаны области устойчивого состояния рассмотренных форм железа в зависимости от рН раствора и выделена область, внутри которой железо будет легко подвергаться анодному окислению с образованием ионов Fe2+ и Fe3+. Она находится в пределах значений рН = = 0…9 и значений  = (–0,60….+ 0,8 В). На диаграмме также штриховыми линиями показана область термодинамической устойчивости воды. Диаграмма Пурбе позволяет оценить термодинамически вероятное поведение металлов в водных растворах, установить пределы потенциалов и рН, внутри которых данный металл будет устойчив и обосновать, за счет какой реакции (выделение водорода или восстановление кислорода) идет растворение металла.
= (–0,60….+ 0,8 В). На диаграмме также штриховыми линиями показана область термодинамической устойчивости воды. Диаграмма Пурбе позволяет оценить термодинамически вероятное поведение металлов в водных растворах, установить пределы потенциалов и рН, внутри которых данный металл будет устойчив и обосновать, за счет какой реакции (выделение водорода или восстановление кислорода) идет растворение металла.
|
|
|
Расчеты показывают, что окисление железа будет наиболее полно протекать при рН 1-4, а процессы его гидролиза и осаждения в виде гидроксидов при рН 6-12.
φ
 рН
рН
Рис. 3.6. Диаграмма Пурбе
Кокс или другой углеродсодержащий материал в гальванопаре поляризуется катодно. В присутствии кислорода на катоде протекают реакции: 2Н2О + О2 + 4е = 4ОН-; 2Н2О+ 4е = Н2 + 4ОН-; Ме п ++ п е = Ме
Катодные процессы сопровождаются повышением рН среды и способствуют образованию гидроксидов металлов.
Полнота протекания электрохимических процессов в гальванопаре будет определяться разностью электродных потенциалов кислорода и металла. Плотность тока в поле гальванопары зависит от материалов катодных и анодных участков.
Некоторые особенности кинетики процесса гальвано- и электрокоагуляции. Электрохимическая реакция является сложным процессом, состоящим из ряда последовательных или параллельно идущих электрохимических, химических, сорбционных и диффузионных стадий. Скорость процесса определяется лимитирующей стадией.
Скорость непосредственно электрохимической реакции (плотность тока) зависит от концентрации и температуры раствора, условий перемешивания, материала электродных участков и адсорбции на них веществ из раствора.
Под действием тока происходит поляризация электродных участков. В зависимости от природы лимитирующей стадии различают диффузионную, химическую, электрохимическую и фазовые виды поляризации, или перенапряжения.
В короткозамкнутых элементах, характерных для гальванокоагуляции, диффузионная стадия практически не лимитирует процесс. В этом случае наибольшее значение имеет электрохимическая поляризация, возникновение которой обусловлено нарушением электродного равновесия и смещением потенциала электрода от его равновесного значения при переносе заряда через границу раздела фаз между электродом и раствором. При катодной поляризации происходит смещение потенциала электрода в отрицательную область значений, при анодной - в положительную.
Возникающее перенапряжение может быть определено по уравнению Тафеля:
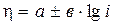 (3.11)
(3.11)
где 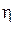 – перенапряжение на катодных или анодных участках соответственно, В;
– перенапряжение на катодных или анодных участках соответственно, В; 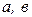 – константы;
– константы; 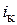 ,
, 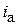 – плотность тока катодных или анодных участков, А/см2. Константа а изменяется в широких пределах в зависимости от природы преобразуемого на электроде вещества, материала и состояния поверхности электрода и других факторов.
– плотность тока катодных или анодных участков, А/см2. Константа а изменяется в широких пределах в зависимости от природы преобразуемого на электроде вещества, материала и состояния поверхности электрода и других факторов.
Анодное растворение металла зависит от его природы, состава электролита, величины поляризации.
Для большинства металлов скорость растворения в электролите монотонно растет по мере смещения потенциала в анодную сторону.
Однако при растворении железа при достижении потенциала, равного нулю, и алюминия при достижении потенциала –1,4 В, наблюдается резкое уменьшение плотности тока, что связано с пассивацией поверхности металлов.
Пассивность металлов объясняется образованием на поверхности анода за счет адсорбции кислорода оксидной или гидроксидной пленок, препятствующих его дальнейшему растворению.
Активирующее действие на металл оказывает анионный состав электролита, при этом наибольшей активирующей способностью обладают хлорид-ионы. Таким образом, процессы электрохимической коагуляции целесообразно проводить в присутствии хлоридов.
|
|
|
Агрегация и коагуляция частиц в процессе гальвано- и электрокоагуляции Воздействие образующихся микротоков на коллоидные системы приводит к их коагуляции за счет поляризационного притяжения частиц в электрическом поле. Под действием электрического поля из коллоидных частиц образуются цепочечные агрегаты, ориентированные вдоль вектора напряженности, изменяется оптическая плотность системы.
Вследствие сдвига рН раствора в процессе коагуляции происходит изменение фазово-дисперсного состояния веществ.
Формирование твердой фазы в объеме раствора зависит от протекания электрохимических процессов, рН и проходит последовательно несколько стадий:
· образование аквакомплексов типа (Al(H2O)3(ОН)3), (Al(H2O)5(ОН))2+ и т.п. за счет ступенчатого гидролиза;
· полимеризацию гидроксокомплексов с образованием многозарядного полимеризационного иона типа (Al2(ОН)5)+, (Al2(ОН)2)4+, (Fe3(ОН)4)5+ и др.;
· взаимодействие ионов Al3+и Fe3+ с анионами с образованием фосфатов, сульфатов и др.
Рост полимеризационного иона приводит к формированию на первой стадии гидроксидов металлов с аморфной структурой, которые кристаллизуются на последующих стадиях.
Гальваногенерированный оксигидрат железа, представляющий собой смесь рентгеноаморфной и кристаллических фаз, состоит из двух модификаций гидроксида железа (III) и гетита с преимущественным преобладанием гидролепидокрита.
При достижении в растворе мольного соотношения Fe(III):Fe(II)=3:l образуется магнетит: Fe2+ + 2Fe3++ 8OH– = Fe3O4 + 4Н2О.
Взаимодействие формирующейся твердой фазы с примесями воды может происходить по механизмам гетерокоагуляции и гомокоагуляции частиц примесей за счет изменения ионной силы, раствора, рН, Eh.
Гетерокоагуляция происходит при взаимодействии разноименно заряженных частиц притяжение частиц происходит в большей мере за счет ионно-электростатических сил, энергия которых значительно превышает энергию межмолекулярных сил Ван-дер-Ваальса, и возрастает с увеличением радиуса частиц.
|
|
|
Гомокоагуляция частиц протекает при очень низких значениях рН (<3) или при высоких (>11), а также при достаточно высоких концентрациях иона металла (0,2 моль/дм3).
Исходя из вышесказанного, целесообразно во всех случаях создавать условия для формирования частиц твердой фазы, имеющих разноименный знак с частицами примесей воды.
Полнота, скорость протекания процесса окисления анодных составляющих гальванопар, состав продуктов будут зависеть от правильно выбранных значений рН исходного раствора. Для создания оптимального режима процесс необходимо проводить в две стадии: 1– активизация окисления анодных участков и 2 – непосредственно гальванокоагуляция. На первой стадии значение рН должно поддерживаться в интервале 3,5–4,5; на второй – 7,5–9,0, что будет способствовать созданию необходимого значения ЭДС гальванопар.
 2015-02-04
2015-02-04 1505
1505








