Все многообразие процессов, происходящих в окружающем нас мире – в природе, в производственных и других условиях, можно разделить на три группы: 1) процессы, для совершения которых требуется затрата работы извне в количестве, прямо пропорциональном производимому изменению. 2) процессы, для течения которых не требуется затраты работы извне и в результате которых не может быть потеряна работа против внешних сил. 3) процессы, которые, могут протекать самопроизвольно, т.е. без затраты работы извне, причем в результате их может быть потеряна работа против внешних сил в количестве, пропорциональном произведенному изменению. Примерами процессов первой группы может служить поднятие какого-либо тела на более высокий уровень, разложение воды действием электрического тока и т.д. Примерами процессов второй группы являются передвижение шара по строго горизонтальной плоскости, или качание маятника без трения. К третьей группе принадлежат такие процессы, как опускание груза на более низкий уровень, взаимная нейтрализация сильной кислоты сильным основанием, любая реакция, используемая в работающем гальваническом элементе, сгорание горючего, взрыв, ржавление железа и т.д. Процессы этой группы называют положительными, в отличие от процессов первой группы, которые называют отрицательными. Основными положениями первого закона, как мы видели, являются утверждения о постоянстве количества внутренней энергии, содержащейся в изолированной системе, и об эквивалентности различных форм энергии, а так же соотношения, связывающие изменения внутренней энергии системы с количеством поступившей теплоты и произведенной работы. При этом первый закон не касается характера, возможности и направления тех процессов, при которых могут или будут происходить те или иные превращения энергии. Другими словами, с точки зрения первого начала термодинамики все процессы происходящие без нарушения закона сохранения энергии, возможны. Однако опыт показывает, что самопроизвольные процессы в природе протекают только в определенных направлениях и до определенного предела. Поэтому первое начало термодинамики необходимо дополнить началом, которое позволяло бы судить о направлениях самопроизвольных процессов и пределах их протекания. Таким началом является эмпирический закон, установленный на основании большого человеческого опыта. Справедливость этого закона подтверждается тем, что ни на одно из его следствий не находится в противоречии с опытом. Второе начало термодинамики тесно связано с существованием необратимых процессов. Прежде всего познакомимся с понятиями необратимые и обратимые процессы в термодинамическом смысл.
|
|
|
16. Статистическая природа второго начала термодинамики.
|
|
|
В то время как первое начало термодинамики является всеобщим законом природы, не знающим ограничений и применимым к любым системам, второе начало термодинамики представляет собой статистический закон, справедливый для макроскопических систем, состоящих из очень большого числа частиц (молекул, атомов, ионов), для которых применимы физические понятия, имеющие статистическую природу (например, как температура, давление).
Известно, что состояние и свойства любой макроскопической системы, состоящей из совокупности большого числа частиц, могут быть описаны с помощью статистической механики. Сущность статистического описания макросистем состоит в применении к совокупности большого числа частиц основных положений теории вероятности, а к отдельным частицам – законов классической механики.
С точки зрения статистической механики второе начало термодинамики, как это впервые было показано Л. Больцманом, сводится к утверждению: все самопроизвольные процессы в макроскопических системах протекают в направлении от менее вероятного к более вероятному состоянию системы.
Таким образом, процессы, запрещенные вторым началом, например самопроизвольный переход тепла от менее нагретого тела к более нагретому, оказываются не невозможными, а крайне маловероятными, вследствие чего они не наблюдаются.
Любое состояние системы характеризуется определенной термодинамической вероятностью, и чем больше последняя, тем ближе система к состоянию равновесия. В состоянии равновесия система обладает максимальной термодинамической вероятностью.
Л. Больцман предложил следующее уравнение, устанавливающее связь между энтропией S и вероятностью ω:
S = k ln ω, (3.24), где k – постоянная Больцмана, численно равная отношению газовой постоянной R к числу Авогадрo NA, т.е. k = R/NA; ω – термодинамическая вероятностьсистемы, т.е. число микросостояний, которыми можно осуществить данное макросостояние системы. Принято группировать их по характеру движения частиц, рассматривая следующие составляющие энтропии: энтропию поступательного движения молекул (Sпост.), энтропию вращательного движения молекул (Sвращ.), энтропию вращательного движения атомов и атомных групп, содержащихся в молекуле (Sвн.вращ.), энтропию колебательного движения атомов и атомных групп (Sкол) и энтропию движения электронов (Sэл.).
Таким образом, энтропию можно представить как сумму следующих составляющих:
S = Sпост +Sвращ + Sвн.вращ + Sкол + Sэл. (3.25)
При этом некоторые из них можно рассматривать как сумму более частных составляющих. Так, Sкол. является суммой составляющих, относящихся к различным видам колебаний.
При рассмотрении обычных химических процессов не учитывают составляющие энтропии, связанные с состоянием атомных ядер (спиновой эффект) и с изотопным эффектом.
Для каждого данного вещества энтропия возрастает при всех процессах, вызываемых движением частиц (испарение, плавление, расширение газов, диффузия и пр.). энтропия возрастает при ослаблении связей между атомами в молекулах и при разрыве их, т.е. диссоциации молекул на атомы или атомные группы. Наоборот, с упрочением связей уменьшается энтропия.
17. Постулат Планка (третье начало термодинамики) как основа расчета абсолютных значений энтропии. Стандартные значения энтропии. В 1912 году М. Планк высказал постулат: при абсолютном нуле энтропия правильно образованного кристалла чистого вещества равна нулю. При абсолютном нуле данное макросостояние кристалла чистого вещества, кристаллическая решетка которого не имеет каких-либо дефектов, предельно упорядочено и может быть реализовано единственным способом. Следовательно, термодинамическая вероятность при абсолютном нуле равна 1:
|
|
|
S = k ln 1 S = 0. (4.1)
На основании постулата Планка можно вычислить абсолютное значение энтропии. Если 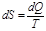 , а
, а 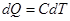 , то
, то 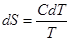 , где С – молярная теплоемкость данного вещества.
, где С – молярная теплоемкость данного вещества.
Интегрируя последнее уравнение в пределах от абсолютного нуля до Т, получим:
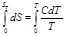 (4.2)
(4.2)
или
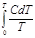 . (4.3)
. (4.3)
Абсолютные и стандартные значения энтропии.
Энтропию ST называют абсолютной энтропией. Она численно равна изменению энтропии при равновесном переходе 1 моля кристаллического вещества от абсолютного нуля до данной температуры.
Вычисление абсолютной энтропии по уравнению (4.3) возможно лишь в том случае, если известна зависимость теплоемкости данного вещества от температуры.
Абсолютную энтропию тела в стандартном состоянии при данном Т называют стандартной энтропией и обозначают через S0T; чаще всего Т=298.15 °К и ее обозначают через S0298:
S029 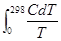 . (4.4)
. (4.4)
Зная стандартную энтропию, можно вычислить значение абсолютной энтропии данного вещества при любой температуре Т:
ST = S0298 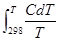 . (4.5)
. (4.5)
Таблицы стандартных значений энтропий играют существенную роль при расчетах констант химических реакционных равновесий и определении направления протекания химических реакций и других процессов.
Необходимо подчеркнуть, что третье начало термодинамики дает возможность вычислить абсолютное значение энтропии различного рода веществ при данном состоянии, тогда как для других термодинамических функций (U, H) могут быть определены только их изменения при переходе данной системы из одного состояния в другое.
18. Расчеты применения энтропии в различных процессах (изотермический, неизотермический, сложный), расчет изменения энтропии в химическом и биохимическом процессах. Методов непосредственного измерения энтропии не существует, но можно рассчитать изменение этой функции при различного рода процессах, пользуясь математическим выражением второго начала термодинамики для обратимых процессов. Так как энтропия является функцией состояния, то ее изменение при переходе системы из начального состояния в конечное будет одним и тем же независимо от того, совершается ли этот переход обратимым или необратимым путем.
|
|
|
 2015-02-04
2015-02-04 2079
2079
