С помощью стехиометрических коэффициентов схема химической реакции переходит в ее уравнение, которое в явном виде отражает закон сохранения количества атомов каждого вида при переходе от исходных веществ (реагентов) к продуктам реакции.
Стехиометрические коэффициенты позволяют установить связь между количествами участвующих в реакции веществ на основе следующего правила:
коэффициенты в химическом уравнении задают молярные пропорции (отношения), в которых вступают в реакцию исходные вещества (реагенты) и образуются продукты реакции.
Рассмотрим в качестве примера реакцию синтеза аммиака:
3H2 + N2 = 2NH3 ,
для которой согласно приведенному правилу можно записать
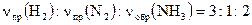 ,
,
где индексы «пр.» и «обр.» соответствуют количествам прореагировавших и образовавшихся веществ. Последнее соотношение можно представить в ином виде:
а) для веществ H2 и N2: 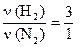
или в другой форме 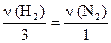 ;
;
б) для веществ H2 и NH3: 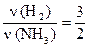 или
или 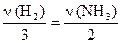 ;
;
в) для веществ N2 и NH3: 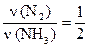 или
или 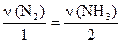 .
.
Легко видеть, что все пропорции можно объединить и записать в виде:
|
|
|
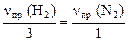 =
= 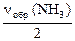 .
.
Последнее равенство является основным расчетным уравнением, связывающим количества прореагировавших веществ и образовавшихся продуктов реакции. При необходимости в это уравнение можно из условия задачи ввести массы и объемы участников реакции, используя обычные соотношения.
Например, для реакции
4FeS2(т) + 11О2 = 2Fe2O3(т) + 8SO2(г)
основное расчетное уравнение имеет вид:
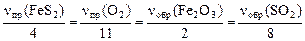
и если в него ввести обычно задаваемые в задачах для твердых веществ их массы, а для газов – объемы, то оно примет следующую форму:
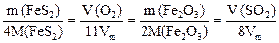
Методика вычислений с использованием основного расчетного уравнения химической реакции включает в себя несколько общих моментов:
1) Прежде всего определяют опорное вещество, по количеству которого проводят весь последующий расчет. В условии задачи для него задана или масса, или объем, или концентрация, которые, в свою очередь, позволяют вычислить число молей опорного вещества. Как правило, это не составляет большого труда, а исключение относится к так называемым задачам на избыток и недостаток, когда опорное вещество нужно выбрать из двух исходных. Дело в том, что при приготовлении реакционной смеси исходные вещества можно смешивать в любых пропорциях, но реагировать друг с другом они будут всегда в строго определенных пропорциях, которые устанавливают для них стехиометрические коэффициенты в уравнении химической реакции. В этих условиях вполне возможна ситуация, когда одно из исходных веществ прореагирует полностью, а часть другого останется не прореагировавшей и тогда говорят, что первое вещество взято в недостатке по отношению ко второму и, наоборот, второе вещество находится в избытке по отношению к первому. В данном случае в качестве опорного вещества следует выбрать исходное вещество, взятое в недостатке, поскольку именно его количество будет определять как окончание реакции, так и количества образующихся продуктов.
|
|
|
Как определить опорное вещество, если в задаче указаны данные (массы, объемы и др.) для обоих исходных веществ? Пусть в реакцию вступают два вещества А и В
аА + вВ → продукты реакции,
а исходные количества этих веществ n0 (А) и n0 (В) можно вычислить из условия задачи.
Для ответа на поставленный вопрос нужно сравнить два числа 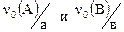 , где возможны три варианта:
, где возможны три варианта:
I вар. 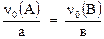 , тогда исходная реакционная смесь называется стехиометрической и в качестве опорного вещества может быть выбрано любое из них – А или В;
, тогда исходная реакционная смесь называется стехиометрической и в качестве опорного вещества может быть выбрано любое из них – А или В;
II вар. 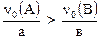 , тогда вещество А взято в избытке и опорным будет вещество В;
, тогда вещество А взято в избытке и опорным будет вещество В;
III вар. 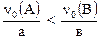 , тогда вещество В будет в избытке и опорным является вещество А.
, тогда вещество В будет в избытке и опорным является вещество А.
Окончание необратимых химических реакций в первом варианте происходит в момент одновременного исчезновения обоих исходных веществ, а в двух других – в момент исчезновения вещества, взятого в недостатке, причем в конечной смеси веществ, наряду с продуктами реакции, будет присутствовать не прореагировавший остаток вещества, взятого в избытке.
2) Из основного расчетного уравнения вытекает простое правило определения числа молей вступивших в реакцию исходных веществ и образовавшихся продуктов по числу молей опорного вещества:
для определения числа молей прореагировавшего или образовавшегося в реакции вещества необходимо число молей опорного вещества разделить на его стехиометрический коэффициент и этот результат умножить на стехиометрический коэффициент определяемого вещества.
Для реакции 2Al + 6HCl = 2AlCl3 + H2,
где опорным веществом, например, является алюминий можно записать:
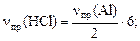
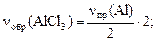
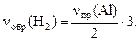
Определив количества интересующих нас веществ, легко рассчитать их массы, объемы и концентрации, то есть те характеристики участников химической реакции, которые фигурируют в условии задачи.
Таким образом, общая схема расчета по уравнению химической реакции может быть представлена в виде:
1. Необратимая реакция.
Пусть 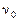 и
и 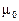 начальные количества реагентов А и В и
начальные количества реагентов А и В и 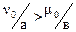 , т.е. вещество А взято в избытке, тогда
, т.е. вещество А взято в избытке, тогда
a A + в В = с С + d D
| начало реакции: | 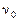 моль
(избыток) моль
(избыток)
| 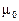 моль
(недостаток) моль
(недостаток)
| ||||
| окончание реакции: | 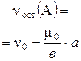
| 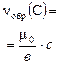
| 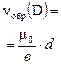
| |||
 2015-04-30
2015-04-30 2353
2353
